- Forschung und Praxis
Runner’s High – aktuelle Evidenz, klinische Relevanz und offene Fragen
Unter gewissen Bedingungen kann bei Läuferinnen und Läufern das Runner’s High einsetzen – ein Hochgefühl mit hohem klinischen Potenzial.
10.06.2025

Das Runner’s High beschreibt einen oftmals plötzlich einsetzenden, ephemeren Zustand aus Euphorie, Gelassenheit, Angstlösung und verminderter Schmerzempfindung während oder kurz nach länger andauernder Ausdauerbelastung. Seit seiner Erstbeschreibung 1978 in dem Buch «Running and Being» von John J. Rate und William A. Smith fasziniert das Phänomen sowohl Neurowissenschaftlerinnen und Neurowissenschaftler als auch Klinikerinnen und Kliniker, weil es neurobiologische Mechanismen offenbart, die sich therapeutisch nutzen lassen könnten. Im Mittelpunkt stehen heute zwei miteinander interagierende Systeme: das Endocannabinoid-(ECB-)System respektive das endogene Cannabinoid-(eCB-)System (ECS) und das endogene Opioidsystem. Hierbei ist der genaue Wirkmechanismus aktuell noch nicht eindeutig geklärt; es zeigen sich jedoch für beide Theorien wissenschaftliche Erklärungen, die im Weiteren kurz erläutert werden sollen.
Endocannabinoid-System – starker Evidenzgrad
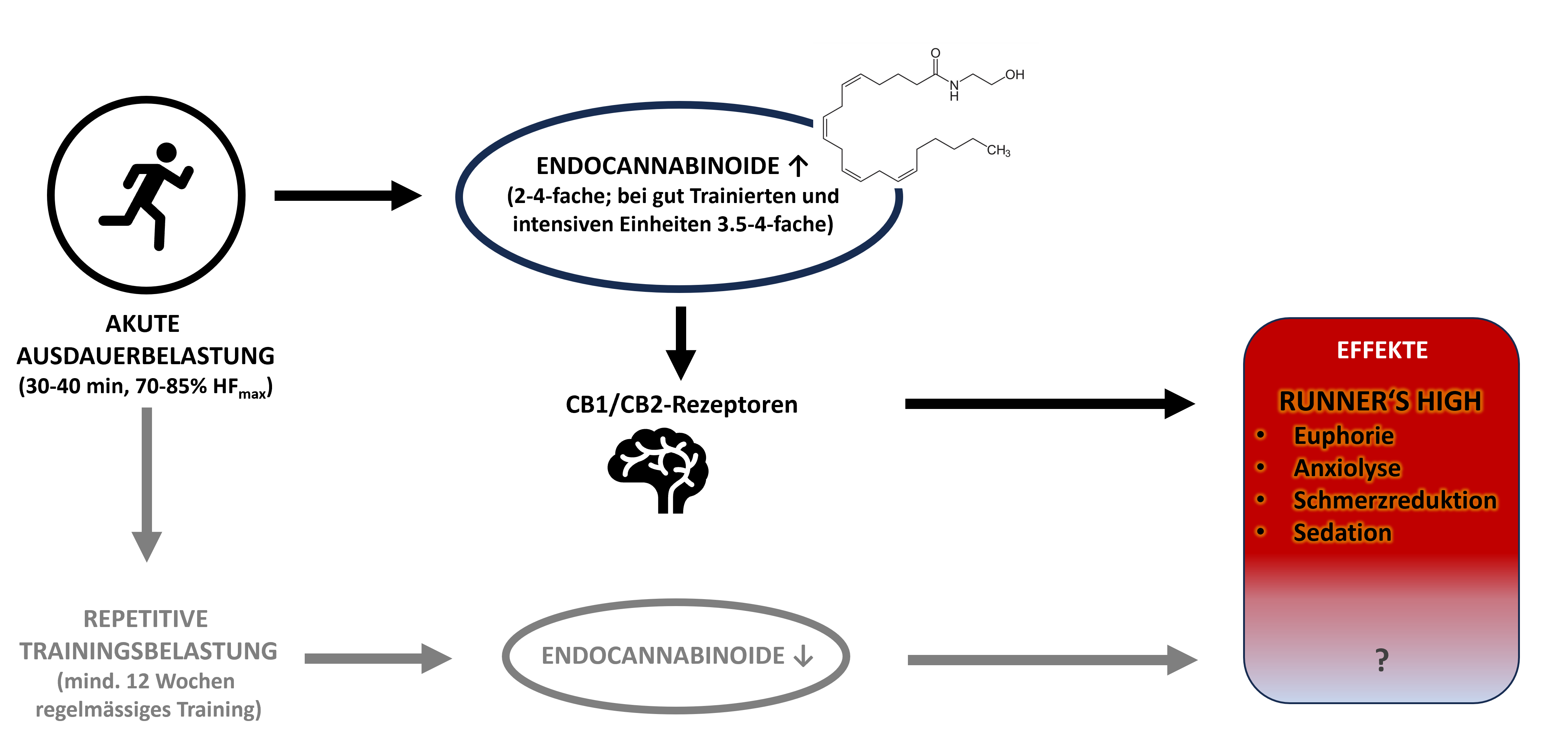
Der zentrale Kandidat ist Anandamid (Arachidonylethanolamid, AEA), eines der beiden Hauptendocannabinoide. Der Name leitet sich vom Sanskrit-Wort «Ananda» ab, was «Glückseligkeit» bedeutet. Anandamid bindet als partialer Agonist sowohl an Cannabinoid-Rezeptor 1 (CB1) als auch an CB2-Rezeptoren, jedoch mit unterschiedlicher Affinität (höher an CB1-Rezeptoren, die primär im zentralen Nervensystem vorkommen). Es konnte gezeigt werden, dass CB1-vermitteltes Anandamid die Schmerzweiterleitung in Rückenmark und Gehirn durch Reduktion der Freisetzung von Neurotransmittern wie Glutamat hemmt und somit eine Hemmung der Schmerzwahrnehmung (Analgesie) auf mehreren Ebenen des Nervensystems und auch eine Modulation der Empfindlichkeit von Nozizeptoren bewirkt. Tierexperimentell konnte gezeigt werden, dass die Blockade von CB1-/CB2-Rezeptoren anxiolytische und analgetische Trainingseffekte verhindert [1].
Mehrere Humanstudien fanden nach 30 bis 45 Minuten Laufen oder Radfahren bei 70 bis 85 Prozent der maximalen Herzfrequenz (HFmax) signifikante AEA-Anstiege, die eng mit subjektiver Euphorie korrelieren [2]. Damit gilt das ECS heute als Hauptvermittler des Runner’s High.
Opioid-/Endorphin-Hypothese – moderate Evidenz
Frühe Arbeiten verorteten den Effekt bei β-Endorphinen, doch deren Hydrophilie verhindert das Passieren der Blut-Hirn-Schranke. PET-Studien mit [18F]-FDPN zeigten allerdings eine reduzierte Opioidrezeptor-Verfügbarkeit in frontolimbischen Regionen nach zweistündigem Dauerlauf; dieser Abfall war invers mit der empfundenen Euphorie assoziiert [3]. Neuere Humanstudien sprechen den Opioiden dagegen eine eher untergeordnete Rolle zu oder wiesen gar deren Belanglosigkeit nach [4].
Weitere Neurotransmitter
Ein weiterer Wirkmechanismus könnte der sogenannte «muscle-brain crosstalk» sein. Hierbei werden im Muskel sogenannte Myokine (z. B. Irisin) freigesetzt, die mit Stimmungsregulation in Verbindung gebracht werden. Darüber hinaus auch IL-6, das – wie andere entzündungsmodulierende Faktoren – kurzfristig das psychische Wohlbefinden beeinflussen kann.
Auch scheint Training mit einer Dauer von mindestens 30 Minuten eine Freisetzung von Dopamin im Belohnungssystem, Serotonin im Raphe-System und BDNF zu fördern, was die kognitiven Funktionen verbessern soll. Diese Effekte sind jedoch komplex und werden meist indirekt vermittelt.
Trainingsparameter für ein sicheres «High»
Anhand der bisherigen Literatur lassen sich folgende praxisnahe Richtwerte ableiten:
- Form: Laufen erzielt die höchsten AEA-Spitzen, gefolgt von Radfahren.
- Intensität: Belastungen bei 70 bis 85 Prozent HFmax erhöhen die AEA-Level zuverlässig.
- Dauer: Mindestens 20 Minuten nötig; ausgeprägte Effekte ab 30–40 Minuten.
- Umgebung: Natursettings scheinen das ECS zusätzlich positiv zu modulieren.
- Messfenster: Höchste eCB-Konzentrationen binnen 0 bis 15 Minuten post exercise.
- Effektgrösse: Anstieg der AEA-Level um das 2- bis 4-Fache (im Vergleich zu Ruhewert); bei intensiveren Trainingseinheiten um das 3,5- bis 4-Fache (besonders bei gut trainierten Individuen)
Klinische Anwendung
Depression: Eine systematische Übersichtsarbeit zeigte, dass aerobe Ausdauerprogramme (≥ 12 Wochen, 3×/Woche) antidepressive Effekte besitzen, die einer Pharmakotherapie bei leichter bis mittelschwerer Symptomatik ebenbürtig sind [5].
Angststörungen: In Metaanalysen konnte gezeigt werden, dass regelmässiges Training Angstwerte mit mittlerem Effekt reduziert [6].
Chronischer Schmerz: Akute Effekte in Bezug auf Hypoalgesie sind gut belegt, wohingegen Langzeitdaten heterogen sind und von Intensität, Diagnosen und Messmethoden abhängen.
Therapeutisch sollte daher ein individualisiertes Ausdauertraining (≥ 30 Minuten, 70 bis 85 Prozent HFmax, 3–5×/Woche) in multimodale Konzepte integriert werden.
Kontroversen und Forschungslücken
- Erfassung der Hypoalgesie: uneinheitlicher Nachweis aufgrund divergenter Schmerzassessments.
- Sedierung: Systematische Reviews finden keine klaren Veränderungen der Vigilanz.
- Langzeitadaptationen: Chronisches Training scheint die ECS-Aktivität herunterzuregulieren; die funktionellen Konsequenzen hiervon sind noch unbekannt.
- Interindividuelle Variabilität: Verschiedene Faktoren (Genetik, Trainingszustand, Geschlecht und psychischer Zustand) modulieren die eCB-Antwort und das subjektive Erleben.
- Vagusnerv: Erste Hypothesen sehen eine Aktivierung afferenter Vagus-Bahnen durch eCBs, vergleichbar mit einer Vagus-Stimulationstherapie.
In der untenstehenden Abbildung finden sich die relevanten, aktuell zum Runner’s High bekannten Fakten zusammengefasst.
Ausblick
Künftige Studien sollten eCB-Kinetiken bei Ultra-Events, die Rolle von Fettsäureamid-Hydrolase-(kurz FAAH-)Aktivität, die Interaktion zwischen ECS, Dopamin und Opioidsystem sowie dose-response Kurven für spezifische Patientengruppen klären. PET-Sequenzen mit eCB-spezifischen Liganden und kontinuierliche Blutentnahmen bei Laufstrecken > 30 Kilometer gelten als vielversprechende Ansätze.
Schlussfolgerung
Das Runner’s High ist kein Mythos, sondern ein gut reproduzierbares neurobiologisches Phänomen mit hohem klinischem Potenzial. Während endogene Cannabinoide als Hauptmediatoren gelten, tragen Opioide, Dopamin, Serotonin und BDNF additiv zur positiven Gesamtwirkung bei. Richtig dosiertes Ausdauertraining kann damit ein kostengünstiges, nebenwirkungsarmes Modul in der Therapie von Depression, Angst und chronischem Schmerz darstellen – vorausgesetzt, individuelle Unterschiede werden berücksichtigt und künftige Forschung schliesst die noch vorhandenen Evidenzlücken.
Literatur
- Fuss J, Steinle J, Bindila L, Auer MK, Kirchherr H, Lutz B, Gass P. A runner's high depends on cannabinoid receptors in mice. Proc Natl Acad Sci USA. 2015 Oct 20;112(42):13105–13108.
- Sparling PB, Giuffrida A, Piomelli D, Rosskopf L, Dietrich A. Exercise activates the endocannabinoid system. Neuroreport. 2003 Dec 2;14(17):2209–2211. doi: 10.1097/00001756-200312020-00015. PMID: 14625449.
- Boecker H, Sprenger T, Spilker ME, Henriksen G, Koppenhoefer M, Wagner KJ, Valet M, Berthele A, Tolle TR. The runner's high: opioidergic mechanisms in the human brain. Cereb Cortex. 2008 Nov;18(11):2523–2531. doi: 10.1093/cercor/bhn013. Epub 2008 Feb 21. PMID: 18296435.
- Siebers M, Biedermann SV, Bindila L, Lutz B, Fuss J. 2021. Exercise-induced euphoria and anxiolysis do not depend on endogenous opioids in humans. Psychoneuroendocrinology 126:105173. doi: 10.1016/j.psyneuen.2021.105173. PMID: 33582575.
- Morres ID, Hatzigeorgiadis A, Stathi A, Comoutos N, Arpin-Cribbie C, Krommidas C, Theodorakis Y. Aerobic exercise for adult patients with major depressive disorder in mental health services: A systematic review and meta-analysis. Depress Anxiety. 2019 Jan;36(1):39–53. doi: 10.1002/da.22842.
- Stubbs B, Vancampfort D, Rosenbaum S, Firth J, Cosco T, Veronese N, Salum GA, Schuch FB. An examination of the anxiolytic effects of exercise for people with anxiety and stress-related disorders: A meta-analysis. Psychiatry Res. 2017 Mar;249:102–108. doi: 10.1016/j.psychres.2016.12.020.




